医療機器承認申請 の基礎知識
医療機器は、薬事法の定義に示されているように、
人又は動物の疾病の診断、治療、予防のために使用される機械器具、材料等です。
当然ですが、医薬品と同様その有効性とともに安全性が確保されていなければなりません。
そのため、
医療機器を製造・販売するためには、
薬機法及び関連の法令・通知等で医療機器の製造・販売・管理に関する事項及び関連する業の許認可等について
規定されています。
薬機法の目的
先ずは、薬機法を理解しましょう。
薬事法と言う大変シンプルな名前の法律は、
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」
と覚えられないくらい長い名前の法律に変わりました。
あまりに長いので通常は「薬機法」と言います。
この法律の目的は、第1条にあります。
すなわち、
(目的)
第一条 この法律は、医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の
品質、有効性及び安全性の確保並びにこれらの使用による保健衛生上の危害の発生及び拡大の防止のために必要な規制を行うとともに、
指定薬物の規制に関する措置を講ずるほか、
医療上特にその必要性が高い医薬品、医療機器及び再生医療等製品の研究開発の促進のために必要な措置を講ずることにより、
保健衛生の向上を図ることを目的とする。
1つの文章でこれだけ長いと息が切れませんか?
ようするに、この法律の規制対象は
- 薬品
- 医薬部外品
- 化粧品
- 医療機器
- 再生医療等製品
と言うことです、そして法律の中ではこれらを総じて「医薬品等」と言います。
やはり、中心は医薬品ですね。
規制対象の5つに対し、
- 品質
- 有効性
- 安全性の確保
- 並びにこれらの使用による保健衛生上の危害の発生
- 危害拡大の防止
これらのための法律、それが薬機法です。
また、規制するだけでは能がありませんから、
医療上特にその必要性が高い医薬品、
医療機器
再生医療等製品
上記3点に対し、研究開発の促進のために必要な措置を講ずることにより
保健衛生の向上を図ることも目的になっています。
医薬部外品や化粧品に対しては、手助けしてもらうことができません。
薬機法の中の医療機器
そして、薬機法の第2条には医療機器が以下の様に定義されています。
(註:括弧書きは省いていますが、以下は法律文そのまま)
第4項:医療機器とは
この法律で「医療機器」とは、人若しくは動物の疾病の診断、治療若しくは予防に使用されること、
又は人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等であって、
政令で定めるものをいう。
第5項:高度管理医療機器とは
この法律で「高度管理医療機器」とは、医療機器であって、
副作用又は機能の障害が生じた場合において人の生命及び健康に重大な影響を与えるおそれがあることから
その適切な管理が必要なものとして、
厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。
第6項:管理医療機器とは
この法律で「管理医療機器」とは、高度管理医療機器以外の医療機器であって、
副作用又は機能の障害が生じた場合において人の生命及び健康に影響を与えるおそれがあることから
その適切な管理が必要なものとして、
厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。
第6項:一般医療機器とは
この法律で「一般医療機器」とは、高度管理医療機器及び管理医療機器以外の医療機器であって、
副作用又は機能の障害が生じた場合においても、
人の生命及び健康に影響を与えるおそれがほとんどないものとして、
厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。
第7項:特定保守管理医療機器
この法律で「特定保守管理医療機器」とは、
医療機器のうち、保守点検、修理その他の管理に専門的な知識及び技能を必要とすることから
その適正な管理が行われなければ疾病の診断、治療又は予防に重大な影響を与えるおそれがあるものとして、
厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものをいう。
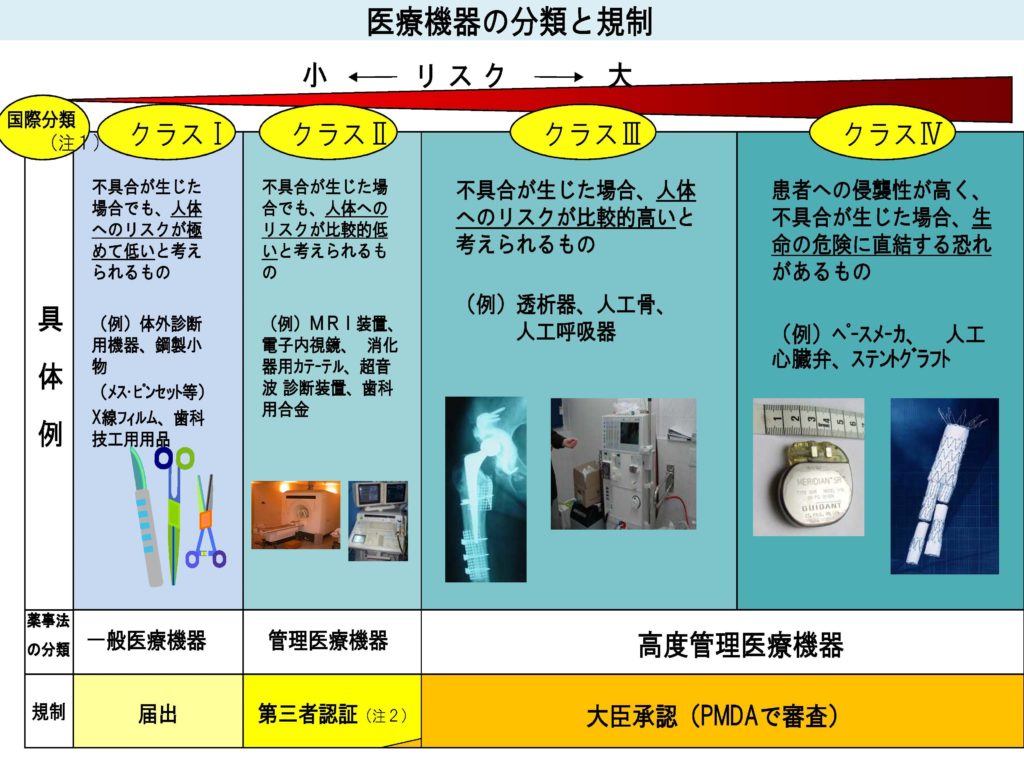
上記の様に
- 高度管理医療機器
- 管理医療機器
- 一般医療機器
- 特定保守管理医療機器
と分けられています。
これは、おもにリスクの大きさによる分類です。
そして、そのリスクによって、クラスⅠ~クラスⅣまで分けられています。
薬機法で見る医療機器の分類
上記の通りです。
- 一般医療機器については届出制度となっています。
- 管理医療機器については認証基準が定められている場合は第三者認証機関による認証が行われます。
- また認証基準のない品目は独立行政法人医薬品医療機器総合機構(以下総合機構という)の審査が行われます。
- 高度管理医療機器については総合機構の審査が行われますが、認証基準が規定されている場合(注)は第三者認証機関による認証が行われます。
さらに、PMDAでは、他の視点でも医療機器を分類しています。
それは、新しい医療機器なのか?
これまでの医療機器を改良したものなのか?
あるいは、これまでの医療機器とほとんど同じものなのか?
です。これを以下のように分類しています。
新医療機器
既に製造販売の承認を与えられている医療機器と構造、使用方法、効果又は性能が明らかに異なる医療機器を言います。
改良医療機器
「新医療機器」又は「後発医療機器」のいずれにも該当しないものを言います。
後発医療機器
既承認医療機器と構造、使用方法、効能、効果及び性能等が同一性を有すると認められる医療機器であり、
既承認医療機器と構造、使用方法、効果及び性能が実質的に同等であるものを言います。
ISO13485:2016+QMS省令対応の品質マニュアルのお求めは、上の画像をクリックして下さい。