ISO13485 品質マニュアルを理解する 設計・開発 7.3
ISO13485 品質マニュアルを理解する 一般 7.3.1
要求事項
7.3.1 一般
組織は、設計・開発の~~中略~~
全部引用したいのですが、著作権の問題があるので出来ません。
いずれにしても、13485を取得するのであれば、規格の本は購入して下さい。
この項で言っていること
7.3.1 設計・開発のルールを決める
設計・開発に関する手順を文書で明確にする。
目的
ISO13485:2016版では、設計・開発の移管活動を明確にするための要求事項を加えました。
この追加は、設計・開発プロセスで製造の実現可能性を考慮することが必要だと言うことを強調しています。
設計・開発移管のための適正な設計・開発プロセスは、
生産に移った製品が意図した用途に適した医療機器として、販売されることになるでしょう。
何をするべきか:5.4.1
この項の要求事項は、設計管理と言われます。
要求事項はとても短いのですが、設計開発に関する重要な要求事項なので、何をするべきか、ここの説明は長くなります。
しっかり理解して下さい。
優良な設計・開発プロセスは、設計・開発の不可欠な部分として、アウトプットに対し体系的な評価を合んでいます。
言い換えると、どの段階のプロセスもしっかりレビューすることを求めています。
この項の要求事項は、設計・開発管理をプロセスに組み込まれた活動と手順の相互関係を持った一組として構築することを意図しています。
焦点となるのは、設計・開発アウトプットがユーザニーズに基づく設計・開発インプットを満足することを確実にすることです。
設計・開発前動の体系的なレビューは、手戻りを防ぐために実行されます。
レビューの結果として、設計・開発インプットからもたらされた要求事項の不備や、提示された要求事項とアウトプットの間の食い違いが設計・開発プロセスの早い段階で明白にされ、修正されます。
下にある図1は、設計・開発プロセスのキーコンセプトを示した図です。
実際に、このアプローチは設計者と管理者に設計・開発プロセスの理解の高まりと視認性の改善をもたらします。
設計者には、使用者及び患者のニーズに対するアウトプットの適合の程度について理解が深まること、
及び設計・開発プロセスの全ての参加者間のコミュニケーション及び調整の改善の両方により利益がもたらされます。
視認性が向上することで、管理者は、設計・開発プロセスをより効果的に方向付け、
問題を早期に認識し、修正し、資源の配分を調整することに力を注ぐことができるようになります。
図1に示された設計・開発プロセスは、設計・開発がフェーズ又はステージの論理的な順序で進む伝統的なモデルです。
基本的に要求事項が明らかにされ、医療機器はそれらの要求事項に合致するように創り出されます。
その後、その図面は検証され、パリデートされ、製造に移管され、最終的に製品として具現化されます。
図にあるように、プロセスの各フェーズとその前のフェーズの間に設計・開発の反復的特性を示すフィードパック経路が必要です。
しかしながら、設計・開発プロセスにおける設計管理の影響力をより明瞭にするために、
フィードパックの詳細は図1に描かれていません。
設計・開発インプットと設計・開発アウトプットの検証の重要性がこの例によって示されています。
インプットがレビューされ、受入れ可能とされた時点から、
インプットを医療機器に変換する反復プロセスが始まります。
最初のステップはシステムへのインプット又は高次の仕様への変換です。
要するに、顧客の要求⇒仕様書⇒図面⇒製造工程⇒医療機器
上記のように進めながら、それぞれを検証し必要があれば前の工程に戻します。
この基本的な技法が,設計・開発プロセスを通して繰り返し使われます。
それぞれのインプットがアウトプットに変換され、それぞれのアウトプットは、
インプットに適合していることが検証され、プロセスの次のステップのインプットになります。
このようにしてインプットは要求事項に適合する医療機器に変換されます。
設計・開発レビューの重要性もまたこの例により示されます。
レビューは、設計・開発プロセスの戦略的な時点で実施すれば良いのです。
例えば、インプットがアウトプットに変換される前にインプットが適正であることを確実にするためにレビューを実施します。
その他のレビューは、
模擬使用試験や臨床評価lのための試作品が製造される前にアウトプットが適正であることを確実にするために利用されます。
他には、医療機器の生産への移管に先立つて実施されます。
一般に、レビューは、活動又はフェーズが許容できる方法で完了します。
次の活動又はフェーズを始めることができるという保証を与えるために用いられます。
図1に示したように、設計・開発バリデーションは、
設計・開発プロセスに従って製造された医療機器が実際にユーザニーズと意図した用途を満たすかどうかという点に取り組むために評価を拡張しています。
図1のモデルは設計管理の導入に有用ですが、実用上の有用性は限られています。
このモデルは、比較的単純な医療機器の設計・開発に適用できます。
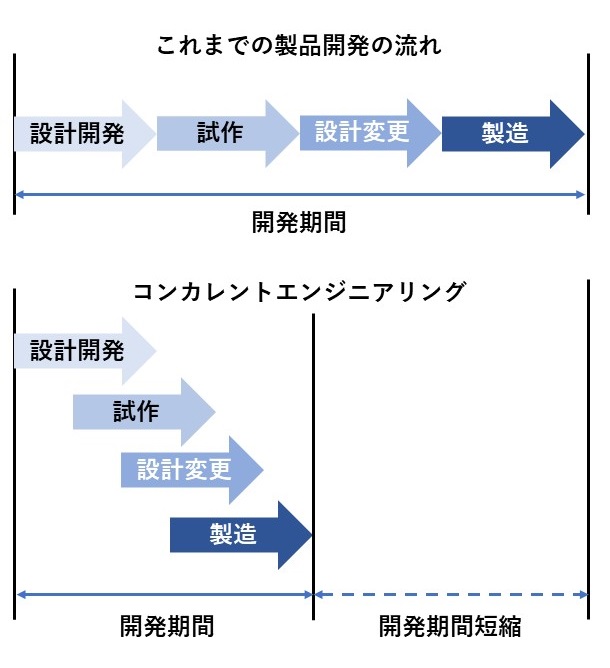
しかしながら、より複雑な医療機器には、コンカレントエンジニアリングモデルが適しています。
コンカレントエンジニアリングは、現在の医療機器産業で用いられる設計・開発プロセスのより代表的なものです。
伝統的な設計・開発シナリオでは、エンジニアリング部門が設計・開発プロセスを完成させ、
公式に製品仕様書・図面を製造部門に移管します。
引き続き、その他のグループ又は機能が、
製品を製造し販売し、サービスする工程に移ります。
歴史的に設計者の意図と製造部門の加工工程では相違がしばしば生じ
、生産性の低さ、手直し、再設計、あるいは製品サービスへの予想外の高コストのような望ましくない結果をもたらしていました。
コンカレントエンジニアリングの利点の一つは、
医療機器の特性及び関連するプロセスを相互に最適化することを確実にしながら
設計・開発プロセスを通して製造とサービスの要素が含まれていることです。
コンカレントエンジニアリングの主な動機は開発時間を短縮し、製造コストを削減することですが、
現実の結果として製品品質が改善されることもあります。
コンカレントエンジニアリングは、技術と実践の範囲を包含します。
設計管理の立場からは、
コンカレントエンジニアリングが設計・開発と製造の間の線引きを暖昧にできることに留意すれば十分です。
一方、コンカレントエンジニアリングモデルは、
生産プロセスの開発が製造活動よりも設計・開発であることを強調しています。
他方で、医療機器の様々な構成品の生産は、
医療機器全体の仕様が承認される前に生産に入ることができます。
このように、設計・開発に関するコンカレントエンジニアリングモデルや他のより複雑なモデルは、
通常、それぞれの構成品とプロセスが生産に人る前にパリデートされる必要があります。
医療機器全体としてリリースの前にパリデートされることを確実にするレビュー及び承認の包括的なマトリックスが要求されます。
リスクマネジメントは、マネジメントの方針、手順、
及びリスクを識別・分析・管理及び監視するタスクの実践に体系的に適用することです。
リスクを上手く管理するために経験、洞察及び判断が適用される枠組みであることを意図しています。
設計・開発プロセスへの影響から、この指針に合めています。
リスクマネジメン卜は、設計・開発インプットを識別することから始まります。
医療機器が設計・開発プロセスを進む中で、
新しいリスクが見いだされることがあります。
組織のシステムはリスクを識別し、必要な場合は低減しなければなりません。
リスクマネジメントプロセスは設計・開発プロセスに統合されます。
この方法で、リスクが特定され、変更が設計・開発プロセスの早い段階で容易かっ低コストで管理できます。
この例として、 一般用途のX線照射装置の暴露管理システムをあげることができます。
管理機能はソフトウェアによって達成されることを意図していた、システムを考えて下さい。
設計・開発プロセスの後期になってからソフトウェアで制御できない幾つかの故障モードが見つかったとします。
そのとき、患者への暴露時間を許容可能なレベルに緩和するパックアップタイマーを追加するための高価な設計変更を実施しなければならなくなります。
設計管理を実行するために必要な手順と作業標準に加えて、
設計・開発プロセスの中で考慮しなければならない医療機器の安全性と性能以外の他の因子を決定するための方針と手順が必要です。
方針と手順の例として以下があります。
- リスクマネジメント
- 医療機滞の信頼性
- 医療機搭の耐久性
- 医療機器の保守点検の容易さ
- 医療機協のサービスの容易さ
- ヒューマンファクターエンジニアリング
- ソフトウェアエンジニアリング
- 規格の利用
- 構成管理
- 法的要求事項の遵守
- 医療機器の評価(第三者の製品認証や承認も含み得る)
- 臨床評価
- 文書管理
- コンサルタントの利用
- 外部パーティの利用
- 組織の経験・過去データの利用
ISO13485:2016+QMS省令対応の品質マニュアルのお求めは、上の画像をクリックして下さい。